一文读懂|全球首款自复制RNA(saRNA)疫苗ARCT-154背后的专利

注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表本公众号立场。任何文章转载需得到授权。
导读:自复制RNA(saRNA)编码RNA复制酶,能够在体内扩增目标蛋白RNA。因此,saRNA在远低于常规mRNA的剂量下可实现高水平的蛋白表达,是一种理想的疫苗/药物平台。目前,saRNA的开发方向包括saRNA疫苗用 于传染性疾病和蛋白替代疗法,包括病毒、细菌、寄生虫等疾病预防和癌症治疗等。
2023年11月,日本厚生劳动省批准了CSL与Arcturus therapeutics联合开发的自复制RNA(saRNA)新冠疫苗:ARCT-154(一款saRNA-LNP冻干制剂),成为全球首款上市的saRNA传染病疫苗。为了解saRNA疫苗的序列设计、LNP脂质组分、LNP包封工艺、以及saRNA-LNP冻干工艺,菌菌汇总了近年来Arcturus Therapeutics申请的saRNA相关专利(WO2021183563, WO2020191103, WO2022056413, WO2022036170),以供参考。

01
saRNA 疫苗的序列设计专利
saRNA和常规mRNA都属于体外转录(IVT)合成的RNA,也称为IVT RNA。在序列组成方面,saRNA有以下序列特征:①saRNA包含常规mRNA序列组成元件:5’ UTR、蛋白编码区(CDS)、3’ UTR和poly(A)尾;②saRNA的序列特征在于:除目标蛋白编码区域外,saRNA还额外涵盖一个编码区域,即位于5’ UTR下游的alpha病毒(甲病毒)等来源的非结构蛋白(nsp)基因序列,以在细胞内表达RNA复制酶;以及目标蛋白编码序列上游的亚基因组启动子序列(SGP)。
Arcturus Therapeutics在WO2021183563中公开了saRNA设计平台STARR的所有序列,即5’ UTR、病毒来源的非结构蛋白(nsp 1-4)、SGP、CDS(GOI)、3’ UTR和poly(A)尾;专利同时介绍了ARTC-021的小鼠免疫原性,也提及了LNP的包封和冻干技术(注:ARTC-021是ARCT-154的上一代产品,编码原始新冠毒株来源的S蛋白)。经序列比对,STARR平台的5’UTR来源于α病毒委内瑞拉马脑炎病毒(VEEV),非结构蛋白(nsp 1-4)来源为α病毒委内瑞拉马脑炎病毒(VEEV)。
菌菌在前期文章中对ARCT-154的序列进行了详细的解析,感兴趣可

SaRNA的序列设计平台STARR(WO2021183563)
02
不同长度RNA的LNP包封专利
Arcturus Therapeutics在专利WO2020191103中公开了使用脂质包封不同长度RNA的流程,测试了脂质纳米颗粒(LNP)的包封率、粒径和多分散系数(PDI)。
RNA-LNP的脂质组分:阳离子脂质、DSPC、胆固醇和PEG脂质(PEG-DMG)的比例为48-60 : 5-10 : 28-38 : 0.5-3.0。

专利WO2020061426A2
RNA-LNP的包封流程:将RNA换液至乙酸溶液中,得到水相;4种脂质按照一定比例混合溶解在乙醇中,得到乙醇相。含RNA的水相溶液通过KNAUER高精度低脉冲泵进入水相入口;含脂质的乙醇相由泵进入脂质入口,流速范围在25~87.5 mL/min。RNA的流速为脂质流速的3倍,流出液为25%的乙醇溶液。随后将流出液在缓冲液中稀释,切向流过滤去除游离RNA和乙醇。
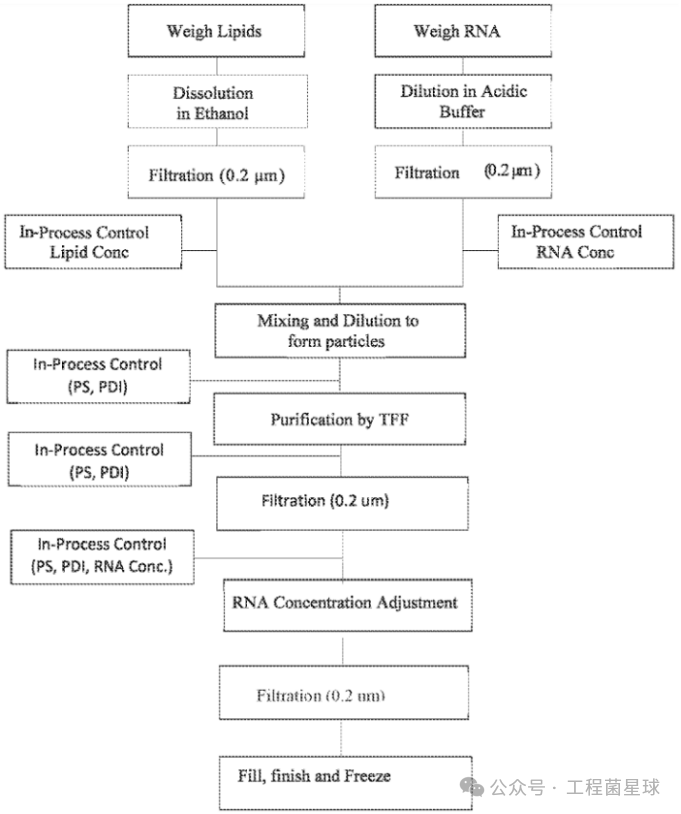
SaRNA-LNP的包封流程(WO2020191103)
这项专利没有专注于saRNA的包封,而是测试了不同长度的线性RNA。但开发人员实例列举了如何使用LNP包封长度约12000 nt(saRNA常规长度)的线性RNA。在该专利中,长度800 nt至12,000 nt的线性RNA的包封率均达到95%以上,粒径也在100 nm以下。但对于多分散系数(PDI)这一质量属性,12000 nt的长链RNA的粒径分布较差(PDI=0.2)。为此,Arcturus Therapeutics又在下述专利中对LNP包封工艺进行了优化。
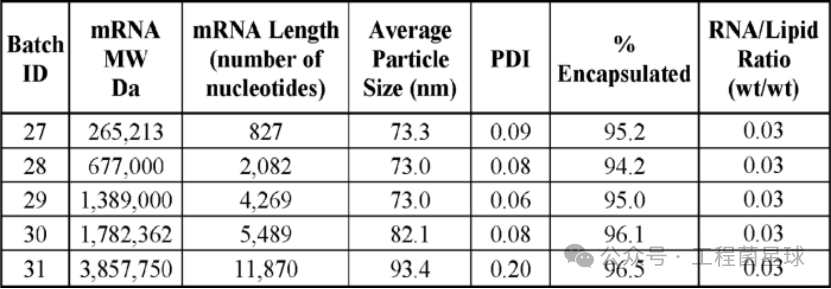
不同长度RNA-LNP的包封效果(WO2020191103)
03
saRNA的LNP包封专利
在专利WO2022056413中,Arcturus Therapeutics公开了适合更长的saRNA的包封工艺,关键点在于降低混合流速和剪切力。具体方法为:
SaRNA-LNP脂质组分和比例:阳离子脂质、DSPC、胆固醇和PEG脂质(PEG-DMG)的比例为50:10:38.5:1.5。
RNA-LNP的包封流程:总脂质:RNA的质量比约为35.78:1,乙醇相和水相流速分别控制在30~75、90~225 mL/min。结果显示,包封率方面,相比120-200 ml/min,333 ml/min总流速下的包封率明显降低;粒径和PDI的大致趋势为,随着流速的降低,saRNA-LNP的粒径明显增加,PDI系数也增大。过高的流速对saRNA-LNP的质量不利。
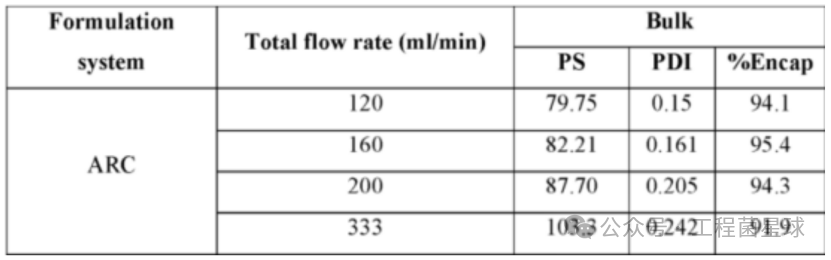
不同流速对saRNA-LNP包封效果的影响(WO2022056413)
04
saRNA-LNP的冻干工艺专利
冻干是解决saRNA-LNP保存和运输的有效方案,首款上市的ARCT-154也是冻干粉剂型。Arcturus Therapeutics在专利WO2022036170中介绍了saRNA-LNP制剂的冻干工艺。开发人员通过比较LNP冻干制剂与冻干前、常规冷冻/解冻循环(即在-70°C冷冻在室温下解冻)后的LNP制剂,科学性地分析了LNP冻干制剂的质量。
冻干工艺简述如下:
将saRNA-LNP换液至目标缓冲液中:0.01~0.05M山梨酸钾、0.01 ~ 0.10% w/v 泊洛沙姆 188、14~18% w/v蔗糖,25~75 mM NaCl、15 ~ 25 mM pH 8.0 Tris缓冲液。随后至冻干设备中进行冻干。冻干后saRNA-LNP制剂粒径、PDI达到质量要求。冻干前样品saRNA包封率为97%,PDI为0.129;冻干后样品saRNA包封率为93%,PDI为0.152。SaRNA-LNP的冻干参数如下:

SaRNA-LNP的冻干工艺(WO2022036170)
05
总结
Arcturus Therapeutics关于saRNA疫苗的专利发布较为活跃,涵盖了序列、LNP包封、LNP制剂冻干工艺,并由此与Moderna、BioNTech、CureVac等常规mRNA研发企业拉开了差异。
国内外其他布局saRNA的企业包括GSK、Gritstone、VaxEquity、Replicate Bioscience、嘉晨西海等,其技术开发和管线进展也值得我们期待。
参考文献
[1] Perenkov AD, Sergeeva AD, Vedunova MV, Krysko DV. In Vitro Transcribed RNA-Based Platform Vaccines: Past, Present, and Future. Vaccines (Basel). 2023 Oct 16;11(10):1600. doi: 10.3390/vaccines11101600.
[2] Brice Sagot. What IP is behind the self-amplifying mRNA vaccine platform developed by Arcturus Therapeutics? KnowMade. 2023. Jan 4.
