Moderna重磅文章:降低核糖体负载,稳定mRNA,增加蛋白总产出

去年的旧文曾提到Alicia Bicknell认为拥有高核糖体载量的编码序列展现出更高的翻译依赖的 mRNA 降解速率,在特定时间内,产生更少的蛋白。

4月23号,Cell Repoorts上出现一篇非常有意思的文章:Attenuating ribosome load improves protein output from mRNA by limiting translation-dependent mRNA decay,定睛一看,通讯作者正是Alicia Bicknell,原来她是Moderna公司的人,怪不得PPT做的满满的M风。这篇新文章正是对她去年在会议上提出的观点的证据支撑。

我们今天就来好好聊聊这篇对mRNA序列设计极具指导意义的研究。
外源合成的 mRNA 进入细胞质后,蛋白质合成总量取决于蛋白质合成速率和 mRNA 半衰期。蛋白质合成速率取决于参与翻译的 mRNA 分子比例、处于翻译活性状态的核糖体数量以及这些核糖体的延伸速度。mRNA 半衰期由依赖于翻译(translation-dependent)的降解机制和独立于翻译(translation-independent)的降解机制决定。
真核生物内源性 mRNA 主要存在两种常见的降解方式,均依赖于缩短 3''端 polyA 尾巴来启动降解(deadenylation dependent decapping reaction)。以酵母细胞为例,去腺苷酸化由 Pan2/Pan3 complex 和 Ccr4/Pop2/Not complex 来执行。完成去腺苷酸化以后,mRNAs 会发生两种可能的降解途径,一种在 exosome 的作用下,从 3'' 至 5''启动降解;另外一种是更加常见的降解途径,在去帽酶的作用下(Dcp1/Dcp2),去掉帽子结构,然后被 Xrn1 从 5''至 3''降解。
当蛋白翻译发生异常情况,提前终止(premature termination of translation)时,还会触发特殊的独立于去腺苷酸化的 mRNA 降解机制,mRNAs 会遭受独立于去腺苷酸化的去帽反应,或者快速的 3''-5''降解,或者核酸内切酶切割(endonuclease cleavage)。
酵母细胞内源性 mRNA 降解途径
长久以来,人们已经利用内源性转录组对 CDS 序列与蛋白产出之间的关系进行广泛研究。然而,内源性 mRNA 在多个参数上存在差异,包括氨基酸序列、密码子选择、CDS 长度、UTR 序列和长度以及细胞内翻译位置。这使得任何一个参数对蛋白质合成产量的作用变得非常复杂。此外,外源合成的治疗性 mRNA 与内源性 mRNA 的不同之处在于,它们通过内吞途径进入细胞质,它们不被剪接,不被核 RNA 结合蛋白包被,并且通常包含修饰的核苷酸(例如,1-甲基假尿苷)以降低先天免疫刺激。因此,我们不能将源自内源转录组(或质粒编码的 ORFeomes)的调控原理直接推及到外源 mRNA 上。
在 mRNA 疫苗/药物的设计中,mRNA 序列设计是万本之源。你所选择的 CDS 序列和 UTR 序列会直接影响到靶蛋白合成产量和表达持续时间,从而影响给药频率和治疗效果。因此,我们必须建立 mRNA 序列和蛋白合成产量(蛋白合成速率和 mRNA 半衰期)之间的精确关系。
不同的 CDS 序列,不同的半衰期,不同的蛋白总产出。
研究人员设计了 30 个 mRNA,它们具有相同的 UTR,拥有不同的 CDS 序列,均编码 eGFP 蛋白。根据密码子最适性和 CDS 二级结构共分为六组,每组内包含不同的 CDS 序列。
(1)高等密码子适应性+高度二级结构
(2)中等密码子适应性+高度二级结构
(3)高等密码子适应性+中度二级结构
(4)中等密码子适应性+中度二级结构
(5)中等密码子适应性+低度二级结构
(6) 低等密码子适应性+低度二级结构
将上述这些 mRNA 转染 HeLa 细胞和 HEK293 细胞,结果发现,这些 mRNA 的蛋白表达总量在组间差异很大,组内类似,这说明密码子适应性和二级结构在不同类型的细胞中均对 mRNA 的蛋白表达产量造成影响。具有更高密码子适应性和更高结构含量的 CDS 序列设计可实现最大的总蛋白质输出。此外,研究人员还发现采用 LNP 将上述 mRNA 递送进老鼠体内,其蛋白表达总量与 CDS 序列之间的关系与细胞水平类似。
将所有 30 个 mRNA 以等摩尔浓度电穿孔至 HEK293 细胞中,然后定时收集进行 RNA-seq 分析。根据这些 RNA-seq 时间趋势线计算出的物理 mRNA 半衰期(无论翻译状态如何的半衰期)与根据 GFP 荧光曲线拟合得出的功能 mRNA 半衰期非常一致。于是,研究认为,这些 mRNA 构建体的蛋白质合成受到 mRNA 物理半衰期的限制,而与衰变前的非翻译状态或者任何其他的抑制机制无关。与总体蛋白合成趋势一样,mRNA 半衰期同样表现出组间差异大,组内相似的特征。
翻译和去腺苷酸化影响 mRNA 降解
抑制剂乳酰米霉素(LTM)会抑制 mRNA 的翻译起始。通过添加或者不添加乳酰米霉素,研究人员利用 RNA-seq 时间趋势图计算出翻译依然的 mRNA 降解和不依赖于翻译的 mRNA 降解。结果发现,低密码子适应性+低二级结构的 mRNA 降解主要依赖于翻译,而高等密码子适应性+高度二级结构 mRNA 的衰减几乎完全独立于翻译。
采用 3'' 反向脱氧胸苷 (InvdT) 修饰可抑制 mRNA 3''末端发生去腺苷酸化反应。与观察到的翻译依赖性衰减类似,低密码子适应性+低二级结构的 mRNA 降解主要依赖于去腺苷酸化,而高等密码子适应性+高度二级结构 mRNA 的衰减几乎完全独立于去腺苷酸化。翻译依赖性降解和去腺苷化依赖性降解之间的密切相关性表明翻译依赖性降解主要通过去腺苷化依赖性机制完成的。
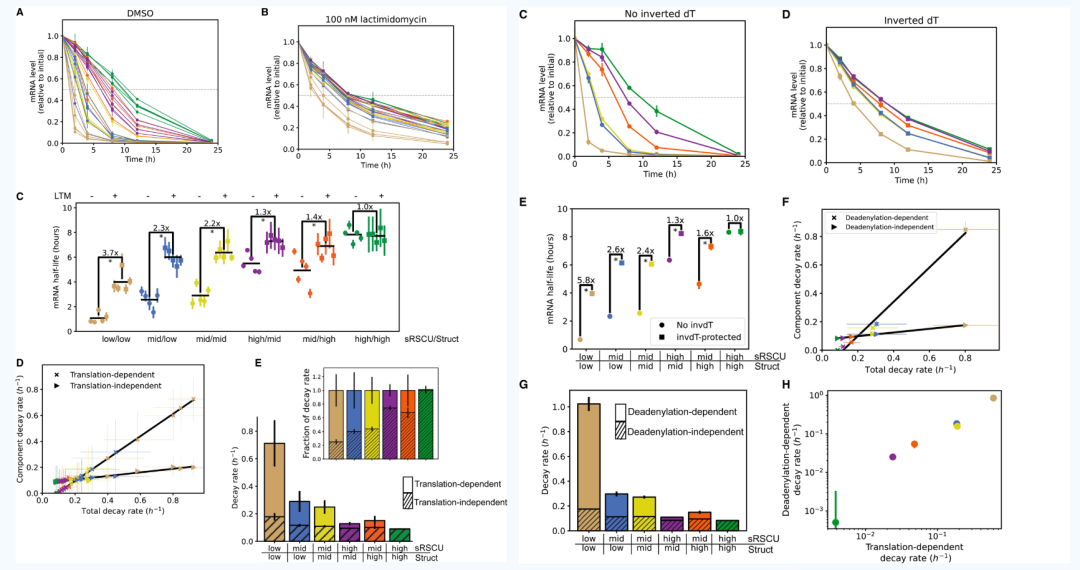
高核糖体负荷导致更快速的 mRNA 降解
不同组别的 mRNA 具有不同的核糖体负载,并且与密码子最优性和结构呈负相关。比较核糖体负荷与 mRNA 半衰期表明,平均核糖体负荷最高的 mRNA 半衰期最短,相反,平均核糖体负荷最低的 mRNA 半衰期最长。核糖体负载也与总蛋白输出也呈负相关。

核糖体负载是与 CDS 长度(对于所有测试的 mRNA 都相同)、翻译起始以及延伸速率相关。检测 GFP mRNA 的延伸速率和起始速率发现两个不同的群体:
(1)mRNA 子集 1(表示为实心圆圈)包含来自较高密码子适应性和较高二级结构的 22 个 mRNA,其延伸率范围为每秒 0.6 至 0.7 个密码子(,起始速率范围为每分钟 0.8 至 1.3 个核糖体。
(2)mRNA 子集 2(表示为空心圆圈)包括低密码子适应性和低二级结构组的所有成员以及来自中等密码子适应性组的其他三个 mRNA。这组 8 个 RNA 显示出缓慢的延伸速率,范围为每秒 0.3 至 0.4 个密码子,这必定是其核糖体负载相对较高的原因。mRNA 子集 2 的翻译起始率也明显较低(每分钟 0.4-0.7 个核糖体),尽管还不足以抵消延伸对核糖体负载的影响。这些低起始率可能是缓慢延伸的次要效应。
在 mRNA 子集 1 中,所有 mRNA 都具有相似的延伸率,但起始速率的多样性更大,并且起始速率与稳态核糖体负载呈正相关。延伸速率解释了 mRNA 子集 1 和 mRNA 子集 2 之间核糖体负载的差异,而起始速率解释了 mRNA 子集 1 内 mRNA 之间核糖体负载的差异。无论是由缓慢延伸驱动( mRNA 子集 2 中的所有 mRNA)还是快速启动(mRNA 子集 1 中具有高核糖体负载的那些)导致的高核糖体载量均与更快的 mRNA 降解相关。

密码子最适性和二级结构影响翻译起始速率
mRNA 子集 1 中的 mRNA 与治疗性 mRNA 设计最相关。对于这些序列来说,不同的起始速率导致核糖体负载的差异,并且与翻译依赖性 mRNA 衰减率呈现相关性。为了研究为什么子集 1 mRNA 表现出不同的起始率,按平均密码子适应性(sRSCU)对该子集中的所有 mRNA 进行分组。子集 1 内的 12 个中 sRSCU mRNA(平均 sRSCU 约 0.8)的起始速率比子集中 10 个高 sRSCU mRNA(平均 sRSCU 约 0.97)快 1.2 倍。子集 1 中不存在低 sRSCU mRNA。然而,sRSCU 差异不太可能是 mRNA 子集 1 中起始速率差异的原因,因为,较高的密码子最适性导致更快的起始速率。
“翻译斜坡”模型是指前 10 个密码子的低最适性减慢了核糖体从起始密码子 (AUG) 附近的解离,从而限制了后续密码子的组装速率。然而,观察到前 10 个密码子的平均 sRSCU 与 mRNA 子集 1 的起始率之间存在负相关 。
因此,全局密码子最优性和局部密码子最优性似乎都无法解释在子集 1 中观察到的 mRNA 之间的起始速率差异。

从 mRNA 5'' 端开始的 35nt 区域的 MFE,以评估编码区开头附近的局部结构与起始率之间的关系。结果发现,负 MFE 值越大,表明局部结构越高,起始率越低。局部二级结构和起始率之间的这种关系也解释了之前局部 sRSCU 和起始率之间令人困惑的关系(在前 10 个密码子中 sRSCU 较低的 RNA 上观察到较高的起始率)——最优性越高的人类密码子往往越 GC 丰富,因此往往会增加 RNA 二级结构。总体而言,这些观察结果表明 mRNA 子集 1 的起始率和核糖体负载的差异可能是由起始密码子附近的二级结构驱动的。

小结
直观上,最大化核糖体密度(产生更大的多核糖体)似乎可以最大化治疗性 mRNA 的总蛋白输出。然而,当前的研究表明,拥有最大的多核糖体的治疗性 mRNA 由于其半衰期显着缩短而产生较低的总蛋白输出。因此,高核糖体密度并不等于高蛋白质产量。而且,核糖体密度(通常通过 riboseq 测量)并不能准确衡量 mRNA 整体“翻译效率”。
最适性差的密码子会影响治疗性 mRNA 的延伸率。当一个或多个密码子最适性足够差以至于出现显著的缓慢延伸,这可能导致非常大的多核糖体和起始抑制(如在 mRNA 子集 2 中观察到的)。相反,对于中度至高度最适性密码子富集的 mRNA,其延伸率受到的影响最小。对于这些 mRNA,起始速率是核糖体负载差异的主要驱动因素。因此,起始速率是优化核糖体负载和最大化总体蛋白质输出的可调杠杆。对于此处测试的中度至高度优化的 mRNA(mRNA 子集 1),决定起始率的主要因素可能是起始密码子周围的局部结构程度。
一句话,CDS 序列的密码子最适性和二级结构会通过调节 mRNA 半衰期来影响蛋白表达总量。这种对 mRNA 半衰期的影响是由 CDS 依赖性翻译动力学差异介导的。具体来说,表达量最高的 mRNA 具有适度的起始速率(每分钟约 1 个核糖体)、适度的核糖体负载(每 170 nt 约 1 个核糖体)以及非常低的翻译依赖性衰减率。
高核糖体负载,无论是由高起始率还是低延伸率引起,都会因翻译依赖性 mRNA 衰减增加而导致治疗性 mRNA 的总体蛋白质输出减少。因此,除了避免次优密码子之外,调节起始速率以实现适度的核糖体负载和更长的 mRNA 寿命是最大化治疗性 mRNA 蛋白质输出的关键。如果无法实现这一点,通过 3'' 端修饰阻断去腺苷化也可能对某些 mRNA 有益。未来还需要研究确定独立于脱腺苷化和独立于翻译的 mRNA 衰减因素,从而提供进一步延长 mRNA 半衰期的方法。
