全面深度解析Ni离子亲和层析,从原理到应用,毫厘SpreX高载量 高分辨 均一传质的超强优势助力!

1961年Helferich首次提出金属离子螯合层析,用于选择性分离小分子。直到20世纪70年代中期,Porath和他的同事才首次报道了IMAC在牛血清蛋白分离纯化中的应用。在随后几年里应用IMAC技术成功纯化了多种蛋白质和多肽,使得IMAC受到广泛关注并得到迅猛的发展。
01
金属螯合层析原理
金属螯合是具有一个或多个自由配位点的金属离子能与供电子基团氮、氧、硫等这些含有孤电子对的原子以配位键的形式结合——简单地说就是金属离子有多余轨道,供电子基团有电子,两者结合后能够以一种比较稳定的形式存在。
金属螯合层析
金属螯合层析则是指通过在填料基质上连接一个能够螯合金属离子的基团,在螯合金属离子后再通过金属离子螯合目的蛋白。其最典型的应用便是在目的蛋白上添加His标签,从而使其获得远强于杂蛋白的螯合强度,使用Ni2+亲和层析介质进行捕获,一步即可获得较高纯度的样品。
02
金属螯合层析填料种类
金属螯合层析填料的配基有多种选择,应用比较多的配基按螯合金属离子能力从弱到强包括亚氨基二乙酸(IDA)、亚硝基三乙酸(NTA)、3-羧甲基乙二胺(TED);固定金属离子通常为具有d层空价电子轨道的过渡金属,按照螯合键强度从强到弱包括Cu2+、Ni2+、Co2+、Zn2+、Fe3+等。对于Cu2+、Ni2+等配位键强度更高的金属离子,虽然由于具有更强的结合蛋白的能力而具有更高的结合载量,但由于结合样品时对其他杂质的结合能力也更高,因此样品纯度相对较低;而使用Zn2+、Fe3+等配位键强度相对较低的金属离子,虽然其载量相对较低,但对于部分杂质难以结合,因此得到的样品纯度相对较高。
通过研究以及实际实验结果,使用Ni2+作为螯合离子来纯化His标签蛋白,具有相对较高的特异性,在纯化收率、纯度以及离子脱落方便都有比较好的表现。毫厘科技的SpreX Ni-NTA Elite/Max以及SpreX Ni-TED经过大量实际应用数据验证,在各个方面的综合性能都有良好的表现。

03
金属螯合层析填料应用场景
His标签蛋白
His标签是为了通过金属螯合层析来实现蛋白质的快速纯化而专门开发的一种标签,通常是在蛋白质的C末端或N末端添加6-10个连续的组氨酸。其具有诸多优点:分子量小不易对蛋白质结构产生影响;免疫原性较低,可直接注射进动物体内;能够适用于多种表达系统;用于his标签蛋白纯化的Ni2+亲和层析填料能够耐受变性剂易于进行纯化等等优点,成为应用最广泛的蛋白标签。
另外需要注意的是,尽管重组蛋白的his标签免疫原性较低,但注射到人体内还是有较高风险,因而此类分子通常尽可能避免使用His标签。
无标签的多肽、蛋白
部分蛋白中虽然没有添加His标签,但其本身就含有较多的His残基,因此可以根据蛋白His残基数量的多少选择合适的金属离子来结合目的蛋白。例如研究发现抗体的CH2和CH3结构域的交界区有一个富含组氨酸的序列,并利用Ni2+金属螯合层析成功得到了纯度90%以上的抗体样品。
根据不同金属螯合能力的强弱以及蛋白质中组氨酸数量的不同,金属螯合层析柱对蛋白质的保留能力也有所不同。基于此,Sulkowski提出利用金属螯合柱识别蛋白质表面His的分布并建立了His的拓扑图。
当蛋白质通过金属螯合柱时仅在IDA-Cu柱保留而不在IDA-Ni、IDA-Co、IDA-Zn柱保留表明蛋白质表面仅有一个可与固定金属离子配位的His。若蛋白质仅被IDA-Cu和IDA-Ni保留而不被IDA-Co和IDA-Zn保留,表明蛋白表面His的分布为—His(Xn)His。若蛋白质在上述四种金属螯合柱都保留表面His的分布可能为—His(Xn)His(n(2,3);α-螺旋)和—HisHis—。
04
Ni2+亲和层析填料选择
选择合适的配基类型
选择合适配基的Ni2+层析填料对Ni2+亲和层析来说是至关重要的,选择了不合适的配基会导致Ni2+脱落或实验纯化效率极低等问题。
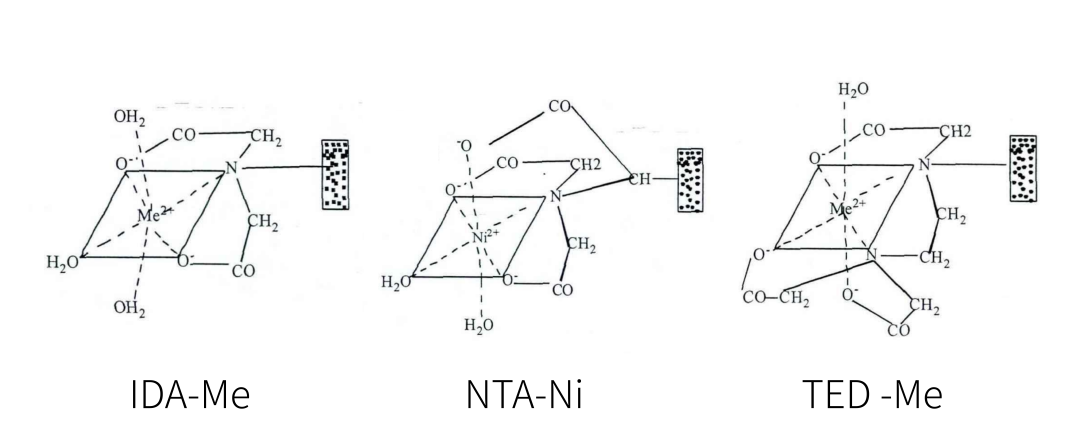
Ni2+一共有6个空电子轨道来形成配位键,IDA配基与Ni2+之间形成3个配位键并剩余3个空轨道,虽然使其具有较高载量,但Ni2+容易脱落;
NTA配基与Ni2+形成4个配位键,剩余2个空的电子轨道,因此其配基相对更加稳定,载量比IDA较低。总体而言具在Ni2+脱落以及载量两方面都具有比较好的表现,目前使用也最多;
TED配基与Ni2+形成5个配位键并剩余1个空轨道,虽然导致其载量相对较低,但其螯合Ni2+的能力很强,甚至能够耐受一定浓度的还原剂和金属螯合剂。
温馨提示
Tip
在实际的应用需求中,首先考察样品及缓冲液中是否含有金属离子螯合剂如EDTA以及还原剂如DTT、巯基乙醇等会导致Ni2+脱落和还原的成分:
如果没有或浓度非常低,则优先选择载量更高的IDA或NTA配基填料,如SpreX Ni-NTAElite/Max;如果有,则推荐使用能够耐受还原剂和金属离子螯合剂的TED配基如SpreX Ni-TED。
填料基球的选择
此外,Ni2+亲和层析因其特异性结合能力,与Protein A亲和层析一样主要用于从细胞培养收获液样品中捕获目的蛋白,因此首先要求其具有较大粒径从而具有较好的压力流速特性。但是其洗脱原理又与ProA亲和层析有所不同,有咪唑竞争结合洗脱和低pH蛋白螯合能力洗脱两种方式,应用较多的是咪唑竞争结合洗脱。毫厘科技的Ni2+层析填料基球基于微流控技术,具有粒径分布高度均一的特点,能够在竞争结合洗脱模式下提供十分优秀的分辨率效果。
金属离子种类的选择
在一些情况下使用Ni2+进行金属螯合层析并不能得到很好的收率或是纯度,此时可以考虑选择其它金属离子。例如一些蛋白没有添加His标签或标签没有完全暴露在蛋白表面,此时就可以尝试选择螯合能力更强的Cu2+来捕获蛋白;当有较多杂蛋白能够与金属离子螯合而导致纯度较低时,可以尝试使用螯合能力较弱的Zn2+和Co2+来进行蛋白纯化。毫厘科技可以为客户提供基于高均一度的琼脂糖基球的各种定制化微球,为蛋白纯化提供全面的服务。
参考文献
[1]Aronld FH.Metal affinity separations:a new dimension in protein processing. Biotechnology,1991,9:151~6
[2]Shan Z,Yang W and Zhang X.PreParation of magnetic nanoparticles and application to ioslation of cells and eatraction of biomacromolecules from biological samples.Chapter 2,book chapter in progress in Nanoparticles Research.New york.USA.Nova Science Publishers,Inc.,2008:57-90
[3]Liu HL,Ho Y,HSU CM.Molecular simulations to determine the chelating mechanisms of various metal ions to the Histag motif:a proliminary study.Journal of Biomolecular Structure and Dynamics,2003,21(1):31~41
[4]李琼.固定化金属离子螯合琼脂糖凝胶的制备及其纯化组氨酸标签蛋白的研究[D].南京理工大学,2012.


往期推荐
